SUMO蛋白是一类泛素样蛋白,通过类似于泛素化的生化机制(称为SUMO化)共价修饰其他蛋白质,从而调控细胞内多种生物学过程,在感染、自身免疫和癌症的免疫调控中起重要作用。SUMO修饰主要发生在细胞核内,通过改变转录因子和染色质重塑复合物的活性来调控基因表达。近年来,SUMO修饰抑制作为癌症免疫治疗方法的临床试验表明,SUMO修饰具有重要的免疫调节作用。
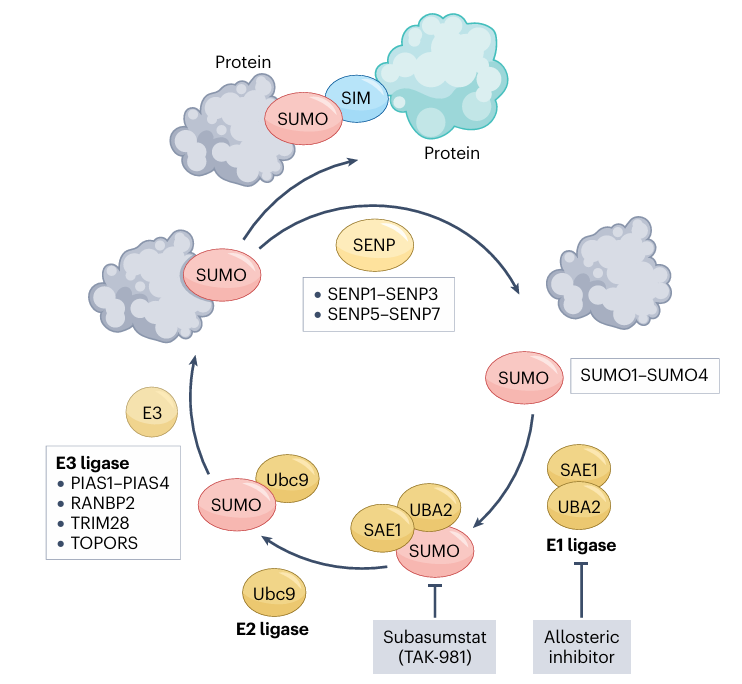
人类细胞表达四种SUMO旁系同源物(SUMO1、SUMO2、SUMO3和SUMO4),它们由相同的E1 和E2酶催化与细胞内其他蛋白质的结合。值得注意的是,SUMO2和SUMO3序列高度相似,而SUMO1与它们的相似度较低,且SUMO1不具备形成多聚SUMO链的能力;而SUMO4主要在免疫细胞中表达,其基因多态性与1型糖尿病的易感性相关。
SUMO修饰由单一的E1活化酶(SAE1/UBA2异二聚体)和E2结合酶(Ubc9)催化,但有超过20种不同的E3连接酶参与。常见的SUMO E3连接酶包括PIAS家族蛋白和TRIM家族成员,它们通过不同的机制促进SUMO与靶蛋白的结合。
哺乳动物有六种去SUMO修饰酶(SENP1-7),它们负责去除SUMO修饰以调节SUMO修饰的动态过程。不同的SENP对不同类型的SUMO修饰具有特异性,例如SENP3和SENP5特异性催化SUMO2和SUMO3的成熟和去修饰。
总体而言,SUMO修饰抑制剂的研发揭示了SUMO修饰在免疫反应调控中的关键作用,包括干扰素反应和T细胞反应的调控。例如,抑制SUMO修饰可增强树突状细胞成熟并赋予对病毒感染的抵抗力,同时增强T细胞启动。此外,抑制SUMO修饰可诱导I型干扰素的产生,并协同脂多糖刺激促进IFNβ的产生。
首先,抑制SUMO修饰通过去除IFNB1远端增强子上的抑制标记来诱导IFNB1的表达,这是一种不同于已知I型干扰素诱导剂的机制。其次,SETDB1和TRIM28的SUMO修饰对于它们结合染色质和介导基因沉默至关重要,抑制SUMO修饰会导致SETDB1从异染色质区域移除。因此,这种非经典机制解释了SUMO修饰抑制与TLR激动剂在驱动IFNB1表达中的协同作用。
一方面,抑制SUMO修饰可能通过诱导内源性逆转录病毒的表达来增加IFNβ的产生,这些逆转录病毒可以产生病毒模拟效应,从而在免疫细胞中诱导干扰素表达。另一方面,SUMO修饰还可能通过调节IFNB1 mRNA的m6A修饰来影响其稳定性,因为m6A修饰会降低IFNB1 mRNA的稳定性。此外,参与m6A修饰的酶和m6A阅读器都是SUMO修饰的底物,抑制SUMO修饰可能会影响IFNB1 mRNA的m6A修饰。
具体来说,细胞质RNA感知蛋白RIG-I和MDA5是SUMO修饰的底物,SUMO修饰抑制了它们的泛素化和随后的蛋白酶体降解。因此,在病毒感染后期,RIG-I和MDA5被去SUMO修饰,导致它们的泛素化和降解,从而调节先天免疫反应的开始和结束。
TRIM5α是逆转录病毒复制的限制因子,其SUMO修饰不影响病毒感染,但其SIM导致TRIM5α在树突状细胞中被隔离在细胞核中,从而抑制其活性。抑制SUMO修饰可诱导TRIM5α在细胞质中的定位,从而阻断细胞质中的逆转录病毒。
一方面,KLF4是巨噬细胞极化的关键转录因子,其SUMO修饰促进巨噬细胞向M2样表型极化,而去SUMO修饰酶SENP1的去除则促进巨噬细胞向M2样表型极化。另一方面,抑制SUMO修饰可促进巨噬细胞向M1样表型极化,并促进其产生炎症细胞因子。
具体来说,IRF1、IRF3、IRF4和IRF7都是SUMO修饰的底物,SUMO修饰抑制了它们的转录活性。抑制IRF4的SUMO修饰可防止其在调节性T细胞中的降解。
SUMO修饰通过使NCoR-HDAC3复合体介导的AP1依赖性转录抑制成为可能,从而参与TLR2和TLR4靶基因的抑制。在癌症细胞中,AP1的SUMO修饰抑制了其活性,但在免疫细胞中的作用尚未见报道。
SUMO修饰通过TLR信号通路参与NF-κB依赖性转录的调控,类似于抑制AP1的机制,核受体介导的转录抑制也参与其中。SUMO修饰通过将PPAR靶向NCoR-HDAC3复合体到炎症基因启动子上来阻止核心抑制复合体的移除,从而抑制基因激活。SUMO修饰还参与调节TLR信号通路中NF-κB激活的上游步骤,例如通过抑制TAB2的SUMO修饰来阻断TRAF6-TAB2-TAK1复合体的形成。
STAT1在三个位点被SUMO修饰,包括与磷酸化位点相邻的Lys703,SUMO修饰通过抑制STAT1磷酸化来抑制I型干扰素信号传导。在星形胶质细胞中,SUMO修饰通过与STAT1形成抑制性复合体来抑制IFN依赖性信号传导,并抑制STAT1介导的转录。

图2 SUMO化与先天免疫感应调控
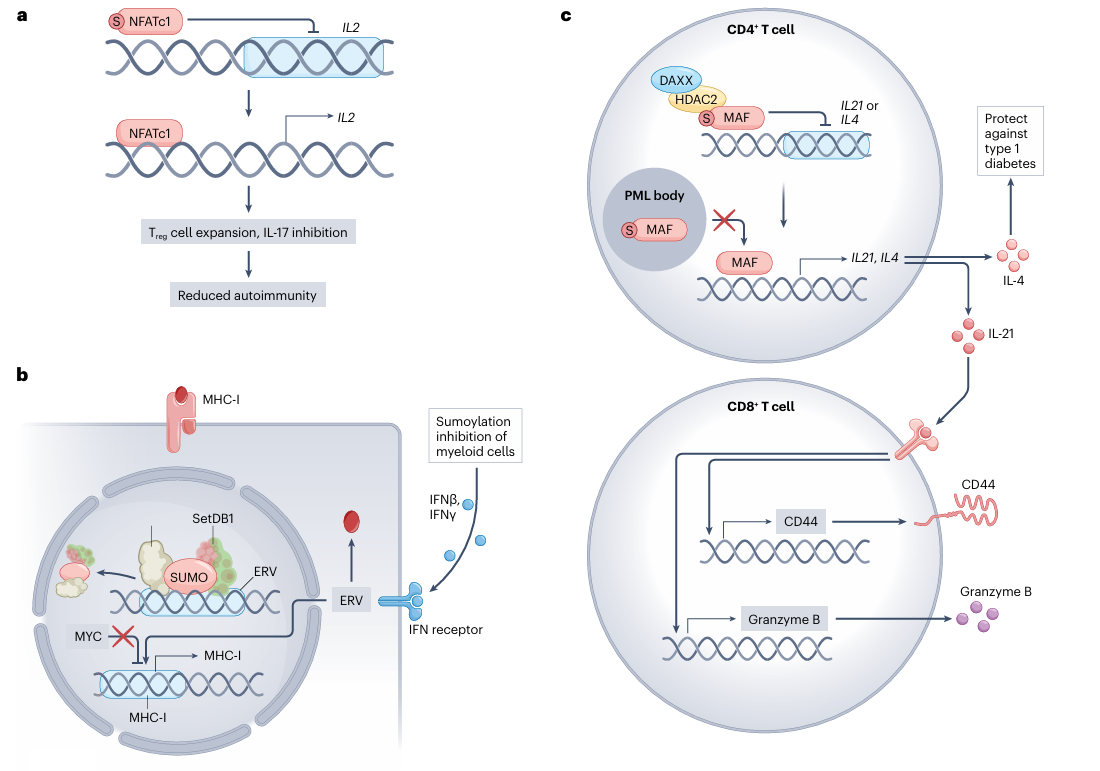
图3 SUMO化对细胞毒性T细胞和自然杀伤细胞的调控
NFATc1的SUMO修饰诱导其与组蛋白去乙酰化酶相互作用,导致染色质失活,并抑制NFATc1介导的IL2表达激活。然而,抑制NFATc1的SUMO修饰可增加IL-2的产生,并促进调节性T细胞的扩增,从而抵消IL-17和IFN的表达并诱导免疫耐受。因此,抑制NFATc1的SUMO修饰在实验性自身免疫性脑脊髓炎模型和移植物抗宿主病模型中均表现出改善疾病的效果。
抑制SUMO修饰可通过多种机制增加肿瘤细胞上的MHC-I表达,例如减少MYC依赖性转录,诱导内源性逆转录病毒表达,以及诱导肿瘤微环境中的干扰素产生。抑制SUMO修饰诱导的内源性逆转录病毒表达还可以作为新抗原,并结合增加的MHC-I表达,进一步增强CD8+ T细胞反应。
MAF是SUMO修饰的靶标,在调节CD4+ T细胞中起重要作用,抑制MAF的SUMO修饰可增强IL-21和IFN的表达。MAF的SUMO修饰还抑制了TH2细胞中IL-4的表达,并影响T细胞向胰腺胰岛的浸润。
抑制SUMO修饰会导致自身免疫表型,类似于Foxp3缺失的动物,这表明SUMO修饰对调节性T细胞的功能至关重要。抑制SUMO修饰会降低调节性T细胞上许多抑制性受体的表达,包括CTLA4、ICOS、CD44、PD-1和LAG3。抑制SUMO修饰会削弱mTOR信号传导,并影响调节性T细胞的稳态和增殖。
RORγt的SUMO修饰对于TH17细胞的分化至关重要,抑制RORγt的SUMO修饰会损害TH17细胞的分化,并使小鼠对TH17细胞介导的EAE产生抵抗力。抑制SUMO修饰会干扰TH17细胞功能,从而减少自身免疫,这表明抑制SUMO修饰可能是治疗多发性硬化症等疾病的新方法。

图4 SUMO化对调节性T细胞和TH17细胞的调控及其对癌症和自身免疫的影响
研究表明,抑制SUMO修饰在多发性硬化症的小鼠模型中显示出减少自身免疫反应和促进髓鞘蛋白产生的效果。此外,抑制SUMO修饰可增加少突胶质细胞前体细胞中MBP的表达,并促进脱髓鞘区域的再髓鞘化,可增加SOX10和MYRF的表达,这些转录因子激活MBP的表达,这可能是再髓鞘化增加的原因。
抑制SUMO修饰在三种小鼠模型中均显示出改善炎症性肠病的效果,并显示出减少疾病进展为败血症的潜力;此外,炎症性肠病患者的结肠活检和小鼠结肠炎模型中的肠道组织均显示SUMO2和SUMO3表达增加。
类风湿性关节炎中,SUMO活性的增加与成纤维样滑膜细胞(FLS)对软骨侵袭的增加有关,这促进了软骨的降解、关节炎症和关节损伤。
SUMO1的上调与FLS细胞对FAS诱导的凋亡的抵抗性有关,因为它与PML蛋白结合并增加DAXX转录抑制蛋白的募集。而激活去SUMO修饰酶(例如SENP1)有助于关节保护,因为它可以逆转DAXX介导的抗凋亡表型,并下调MMP-1的表达。
Subasumstat是目前唯一用于人类的SUMO抑制剂,几项针对癌症的I期和II期临床试验已证明其初步疗效和可接受的安全性。例如,在I期剂量递增试验中,Subasumstat治疗降低了循环白细胞中全局SUMO2和SUMO3修饰,并上调了血液中的干扰素诱导性趋化因子CXCL10和CCL2。此外,Subasumstat治疗诱导了I型干扰素依赖性树突状细胞激活,并增加了小鼠肿瘤模型和疫苗模型中的抗原交叉呈递和T细胞启动。
Subasumstat与其他免疫疗法的联合使用已在临床试验中进行测试,例如与肿瘤靶向抗体联合使用,以增强抗体介导的肿瘤杀伤效果。在头颈部癌症患者的0期试验中,Subasumstat与西妥昔单抗或avelumab联合使用可增强和延长I型干扰素信号传导。在CD20+淋巴瘤中,Subasumstat与利妥昔单抗协同作用,通过放大的I型干扰素介导的M1样巨噬细胞极化和NK细胞激活,增强了对外周血淋巴瘤细胞的细胞毒性。
在Ib期临床试验中,Subasumstat与pembrolizumab(一种PD-1抑制剂)联合使用在微卫星稳定的结直肠癌(CRC)和非小细胞肺癌(NSCLC)患者中均显示出肿瘤消退。Subasumstat增加了T细胞对TCR参与的激活,并减少了Treg细胞的分化,增强了CD4+ 和CD8+ T细胞的干扰素分泌。
在急性髓性白血病(AML)中,Subasumstat与5-氮杂胞苷联合使用可诱导AML细胞分泌I型干扰素,并表达NK受体配体(MICA和MICB)和粘附蛋白(ICAM1)。Subasumstat还通过增加NK细胞脱颗粒能力和炎症细胞因子分泌来增加NK细胞介导的杀伤。在其他血液系统恶性肿瘤中,Subasumstat直接作用于肿瘤细胞以发挥凋亡作用,并使耐药的多发性骨髓瘤细胞系恢复对蛋白酶体抑制剂的敏感性。
首先,临床试验中观察到的SUMO E1抑制的免疫调节效应确立了SUMO修饰在调节免疫中的重要作用。其次,抑制SUMO修饰在癌症中的免疫效应预示着与其他免疫疗法的协同作用,例如与抗PD-1和抗CD20疗法。此外,抑制SUMO修饰可诱导细胞毒性T细胞浸润到肿瘤中,减少Treg细胞数量,增强效应功能,并可能改善T细胞耗竭。同时,抑制SUMO修饰的免疫调节效应表明其可以与癌症靶向治疗相结合,例如与MEK抑制剂、放射治疗和抗体-药物偶联物联合使用。最后,抑制SUMO修饰还显示出治疗炎症性肠病、多发性硬化症和类风湿性关节炎的潜力,尽管这些发现仍需在人类临床试验中验证。