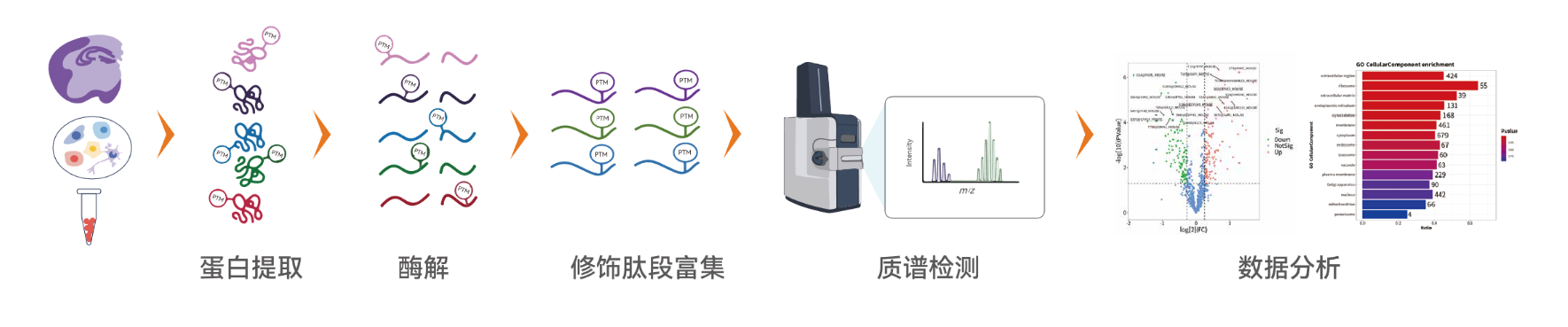
泛素化是仅次于磷酸化的第二常见的蛋白质翻译后修饰,在调节蛋白质稳定性方面起着重要作用,它通过泛素分子(小蛋白)给蛋白质打上“泛素化标签”,标记需要降解或功能改变的蛋白质。就像给垃圾贴上分类标签,泛素-蛋白酶体系统(UPS)负责80-90%的细胞蛋白质降解和10-20%的自噬,也确保了细胞内蛋白质得到适当的处理,有的重新利用,有的被降解,有的被修饰后继续使用。

图1 泛素化和去泛素化过程--泛素-蛋白酶体系统 (UPS)
泛素化和泛素化酶的失调是各种癌症的常见特征,通过研究泛素连接酶和去泛素酶(DUB)深入了解致癌过程和治疗干预措施开发非常重要。为帮助大家拓展研究思路,备战25年国自然,小编将结合2024年7月25日,郑州大学医学院/中美(河南)荷美尔肿瘤研究院团队在《Molecular Cancer》(IF=27.7)上重磅发表的 “Ubiquitination and deubiquitination in cancer: from mechanisms to novel therapeutic approaches”综述文章内容,为大家梳理:
“泛素化标签”有哪些?不同的标签实现不同的功能
泛素化修饰如何进行肿瘤不同热点领域的研究?
从机制-转化,泛素化研究怎么发现新药?
在癌症中,泛素化是一种重要的蛋白质修饰过程,它通过在靶蛋白上附加泛素分子来调节多种细胞活动。泛素化有多种类型,包括:单泛素化:单个泛素分子附着在靶蛋白上,影响DNA修复、基因转录,进而影响癌细胞的生长、转移、辐射抵抗和免疫逃逸。多单泛素化:多个泛素分子附着在同一个靶蛋白的不同赖氨酸残基上。
根据泛素与底物的连接位点,目前有9种方式的泛素化,不同方式的泛素化调控不同的功能。由M1连接的泛素链,由LUBAC复合体组装,OTULIN和CYLD去泛素化酶拆解,通过NF-κB调节在癌症中发挥作用。K48连接的多泛素化:标记蛋白质以供26S蛋白酶体识别和降解,如TRIM7诱导Src激酶的K48链接泛素化,抑制肝细胞癌进展。K63连接的多泛素化:参与信号组装、蛋白质自噬降解,也在癌症转移、免疫逃逸和细胞周期中起作用。非典型泛素链:如K6、K11、K27、K29、K33和M1链,它们在癌症的发展、侵袭、转移和免疫调节中扮演重要角色。
这些泛素化过程共同参与癌症的多个特征,包括持续的增殖信号、逃避生长抑制、抵抗细胞死亡、促进血管生成、激活侵袭和转移、基因组不稳定和突变、炎症促进肿瘤、能量代谢重编程、逃避免疫破坏、表型可塑性、非突变性表观遗传重编程以及微生物组的多态性。
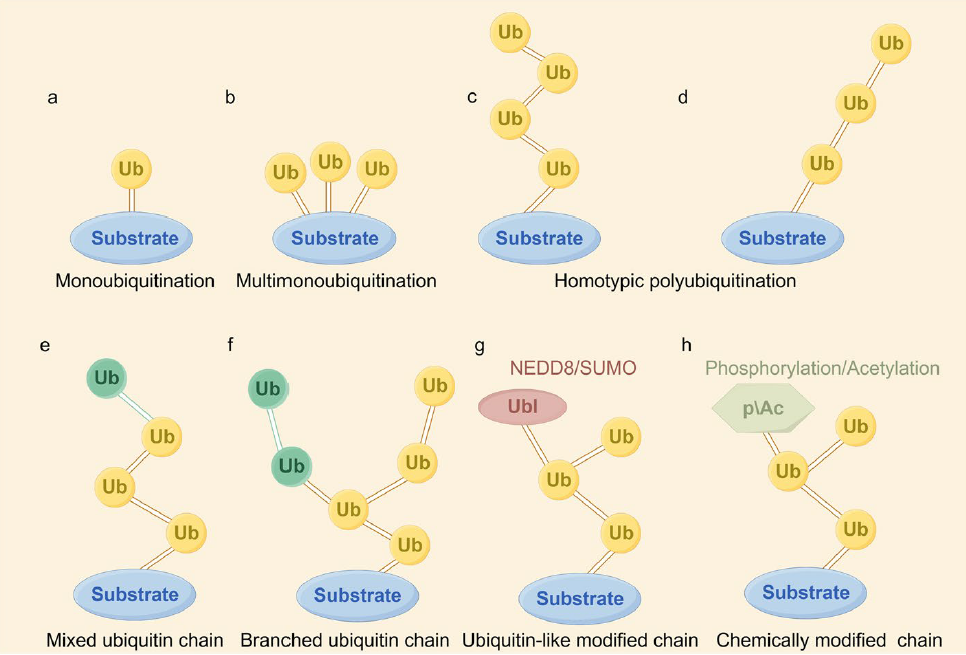
图2 泛素不同连接形式
癌细胞通过E3泛素连接酶和去泛素化酶(DUB)调节蛋白质稳定性和降解,逃避正常生长信号控制实现持续增殖,涉及多个生长相关的信号通路。这些通路包括维持细胞增殖的EGFR信号通路,其中DUBs如Cezanne-1、USP22和USP25防止EGFR降解;MAPK途径中的RAS-RAF-MEK-ERK和JNK/p38途径,E3泛素连接酶和DUBs调节B-Raf和ERK信号;以及AKT在PI3K/AKT/mTOR信号通路中的核心作用。此外,E3泛素连接酶在癌症转移中起作用,基因组不稳定性是癌变的核心,细胞因子促进炎症与约20%的人类癌症相关,泛素化通过调节转录因子和细胞因子促进癌症发展。
癌症组织需要在物质和能量方面进行重新编程,以维持或进一步促进癌症的进展。泛素-蛋白酶体系统通过多种途径调节肿瘤的代谢,包括糖酵解,脂肪酸代谢和氨基酸代谢。通过调节相关代谢酶的活性和稳定性,影响了癌症中细胞的整体能量平衡。
肿瘤微环境中的癌症相关成纤维细胞(CAFs)通过分泌因子调节肿瘤细胞活动,最近文献表明,多种DUBs在在多种癌症类型中正向调控TGF-β信号通路,促进癌症转移。此外,UPS在免疫检查点如PD-1/PD-L1途径中起作用,E3泛素连接酶和DUBs调节PD-1和PD-L1的稳定性,与14种癌症特征相关的泛素化和泛素化酶参见图3。
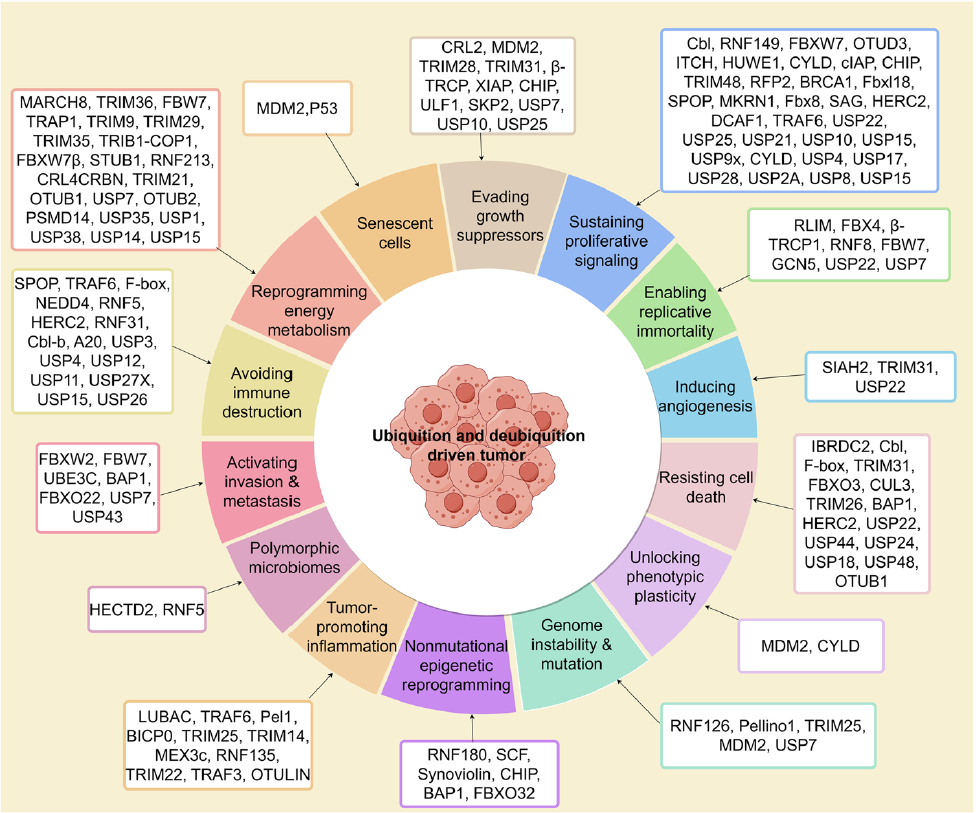
图3 癌症特征的泛素化和去泛素化调节
基于上述机制,研究者们正在开发新型治疗方法:
蛋白酶体抑制剂:如硼替佐米和卡非佐米,已被批准用于多发性骨髓瘤和套细胞淋巴瘤的治疗。
去泛素化酶抑制剂:如来那度胺,通过靶向抑制E3泛素连接酶CRBN发挥抗骨髓瘤活性。
Protacs(蛋白水解靶向嵌合体):如ProTACs,可以模拟去泛素化过程,促进目标蛋白的降解。
分子胶:如分子胶,可以特异性结合并稳定目标蛋白,阻止其被蛋白酶体降解。
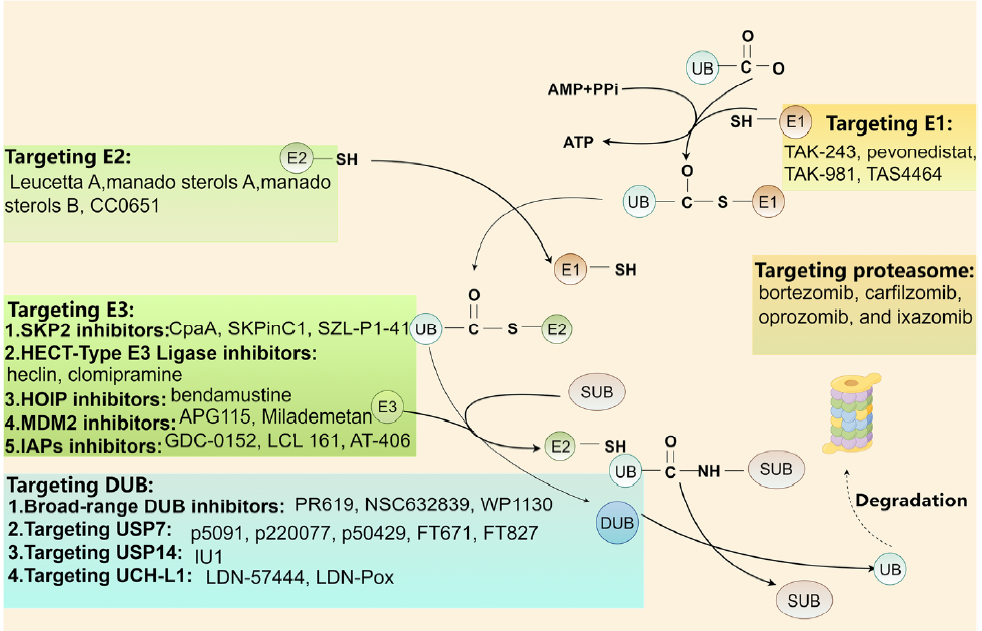
图4 泛素-蛋白酶体系统调节蛋白及其相应治疗策略示意图
过去几十年,泛素-蛋白酶体系统(UPS)研究取得显著进展。本文回顾了UPS在肿瘤特性和治疗策略方面的研究进展。肿瘤特性方面,UPS影响癌症进展的具体机制尚不清楚,需深入探究。
治疗策略上,尽管已有部分临床药物信息,但E1和E2靶向药物知识仍存空白,未来研究应聚焦此领域。UPS在癌症中的潜在治疗靶点已被识别,并研究了相应抑制剂,如硼替佐米等已获FDA批准,但广泛应用受限于副作用。目前正探索E1、E2酶等靶向抑制剂及PROTACs、分子胶水等新型治疗手段。
因UPS在肿瘤增殖中影响多个致癌信号通路,增加了治疗策略的复杂性。多靶点联合治疗成为未来发展方向。进一步探索UPS功能和临床研究对开发新癌症治疗策略具有重要意义。
青莲百奥修饰蛋白组学产品线升级,不仅精心打磨了经典修饰产品线(如磷酸化、糖基化、泛素化等),同时开拓了一系列新型修饰产品线(如乳酸化、酰化修饰、氧化还原等)。现凭借先进的高分辨率、高灵敏度质谱技术,积累了丰富的修饰组学研究经验,提供深入的生物信息学分析报告,为科研工作的深入探索和成果的有效转化提供强有力的支持。欢迎垂询!