风湿免疫性疾病是一组与免疫相关,多器官受累,以自身免疫性炎症为特征的疾病,包括百余种疾病,常见的有系统性红斑狼疮、干燥综合征、类风湿关节炎、强直性脊柱炎等。尽管每一种风湿免疫性疾病均以某个特定器官受损为主,但往往是全身性疾病,临床表现复杂,且多发病隐匿。因此,早诊早治对风湿病患者意义重大。
蛋白质组学是寻找自身免疫病生物标志物的重要方法,其中蛋白质翻译后修饰(Protein translational modifications,PTMs)控制着靶蛋白的功能和稳定性、蛋白相互作用和亚细胞定位等,几乎参与了所有的生物过程,因而针对PTMs可以为风湿免疫性疾病的个体化精准治疗提供一种新思路。
接下来,一起探秘风湿免疫疾病中究竟有哪些PTMs在幕后操控?
2024年5月,华中科技大学同济医院风湿病免疫科钟继新团队在Pharmacological Research(IF=9.1)杂志上发表了题为“Mid1 promotes synovitis in rheumatoid arthritis via ubiquitin-dependent post-translational modification”的研究成果,该研究首次揭示了Mid1通过调节泛素依赖的翻译后修饰在类风湿关节炎(RA)滑膜细胞活化中的关键作用。Mid1属于TRIM家族,具有E3泛素连接酶活性。利用免疫共沉淀和蛋白质组学分析确定了DPP4是Mid1最重要的候选底物蛋白,Mid1通过K48连接的多聚泛素化促进DPP4的降解。最终结果表明Mid1诱导的DPP4泛素化促进了滑膜细胞的增殖和侵袭,从而加剧了RA中的滑膜炎。案例一:Mid1通过泛素化修饰促进类风湿关节炎中的滑膜炎的机制[1]
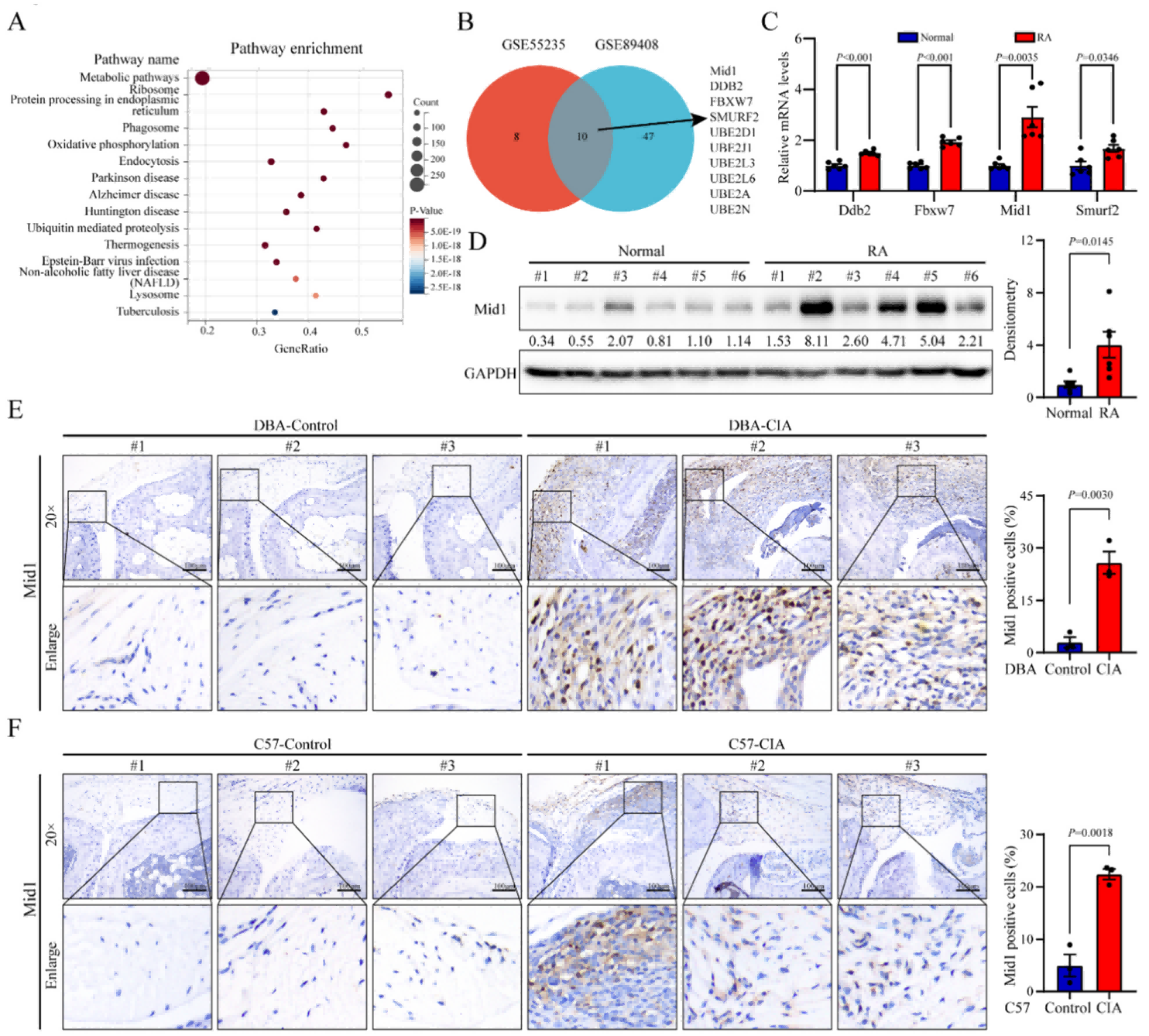
图1:RA患者滑膜组织中Mid1的表达显著升高
2024年4月,北京大学药学院屠鹏飞团队在European Journal of Pharmacology(IF=4.2)上发表了题为“Small-molecule targeting PKM2 provides a molecular basis of lactylation-dependent fibroblast-like synoviocytes proliferation inhibition against rheumatoid arthritis”的研究论文。成纤维样滑膜细胞(FLS)在类风湿性关节炎(RA)相关的肿胀和骨损伤中发挥重要作用,因此,迫切需要发现RA治疗FLS的新靶点。研究人员通过一系列实验确定FLS中的丙酮酸激酶M2(PKM2)是抗疟药物青蒿素(ART)治疗RA的一个药理靶点。进一步探讨了ART与PKM2的相互作用发现ART通过以变构方式靶向p300介导的PKM2乳酸化,对病理FLS具有显著的抗增殖作用。案例二:青蒿素靶向PKM2的乳酸化来抑制成纤维样滑膜细胞的异常增殖[2]
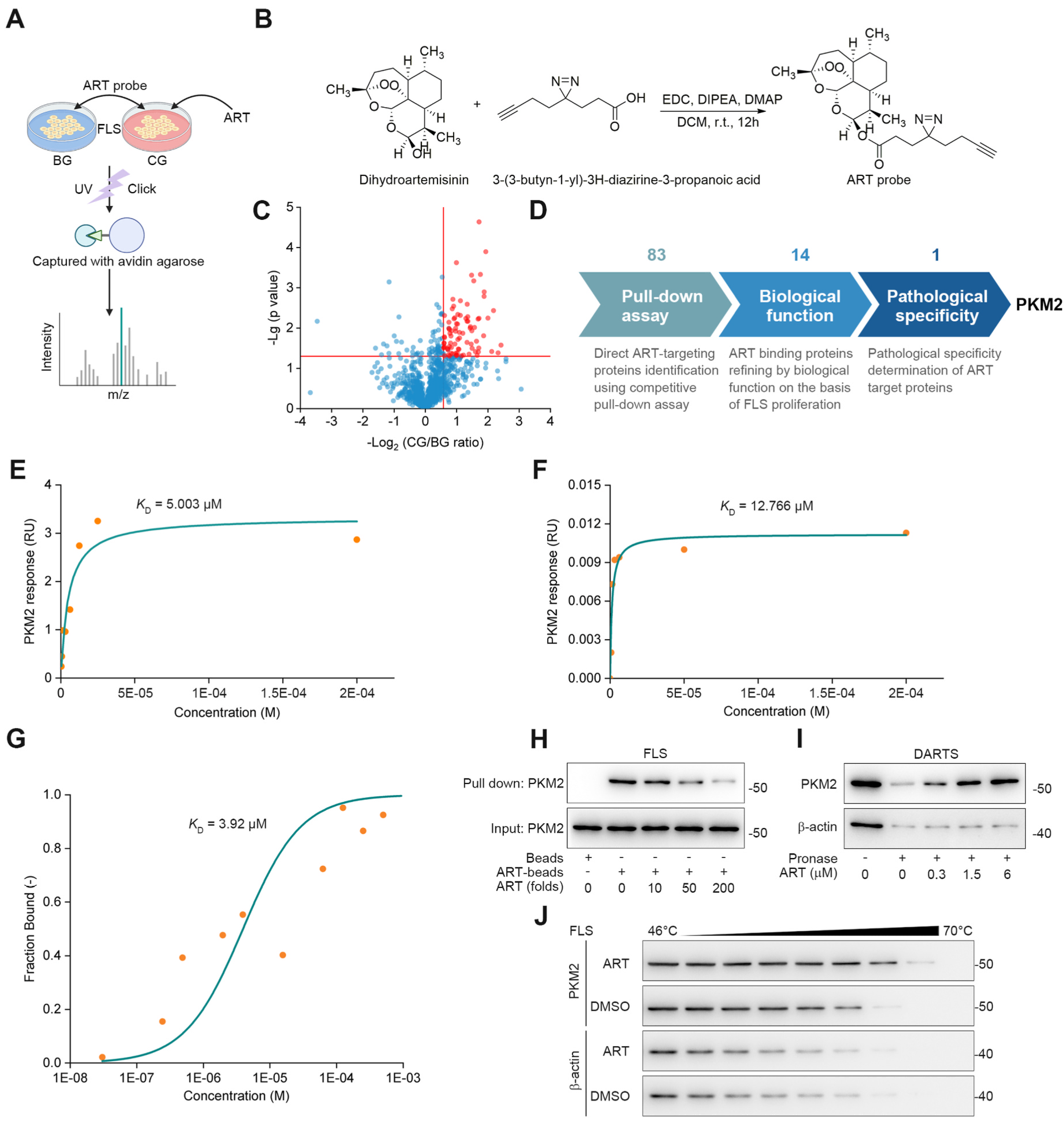
图2:PKM2被确定为天然分子ART的直接细胞靶点
2023年4月,华西医院风湿免疫科戴伦治教授团队在Molecular & Cellular Proteomics(IF=6.1)发表题为“Integrative Proteomics and N-Glycoproteomics Analyses of Rheumatoid Arthritis Synovium Reveal Immune-Associated Glycopeptides”的文章。该研究首次对类风湿性关节炎(RA)和骨关节炎(OA)患者滑膜组织中的N-糖基化蛋白和N-糖基化修饰位点进行描绘。揭示了蛋白质糖基化在RA的免疫病理过程中可能起到关键作用,通过N-糖基化与免疫细胞浸润的关系分析,发现一些特异性N-糖肽与多种免疫细胞相关性较强。案例三:滑膜蛋白组学与糖基化组学揭示类风湿性关节炎免疫相关糖肽[3]
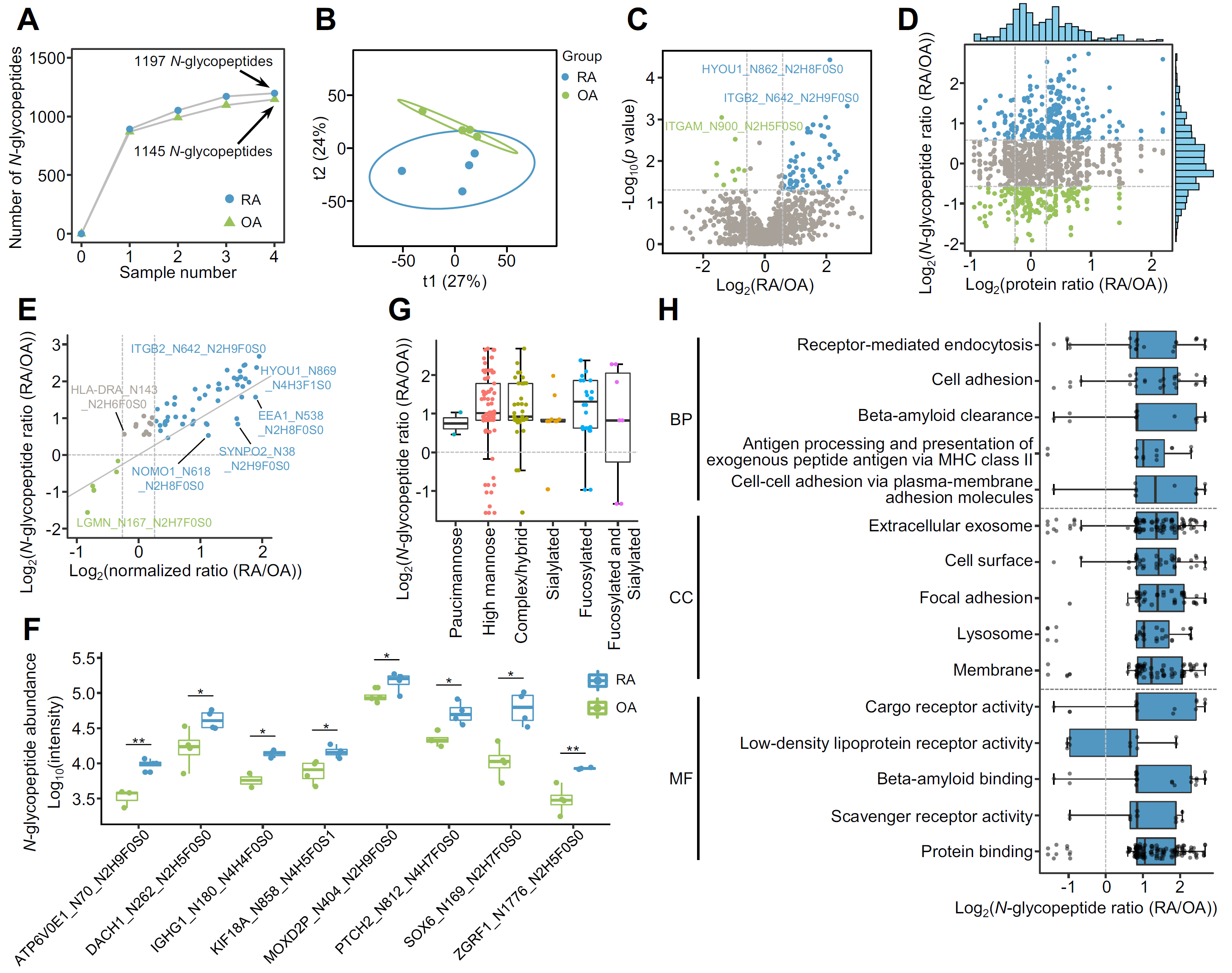
图3:RA和OA滑膜组织中N-糖肽组学分析
2023年3月,空军军医大学朱平团队在Science(IF=44.7)发表题为“Cysteine carboxyethylation generates neoantigens to induce HLA-restricted autoimmunity”的研究论文。强直性脊柱炎(AS)是一种自身免疫性疾病,可由新抗原引起,破坏人类的免疫耐受。PTMs已被证明是一种改变蛋白质结构和功能以产生新抗原并诱导后续自身免疫反应的关键机制。该研究首次发现并鉴定出一种全新的蛋白PTM—半胱氨酸羧基乙基化修饰,由肠道微生物释放的代谢物3-HPA诱导的一种体内蛋白质修饰,羧乙基化修饰的ITGA2B能够诱导AS产生修饰型新生抗原,发生特异性自身免疫反应。为攻克重大自身免疫病提供了“差异修饰蛋白—修饰型新生抗原”的系统方法策略案例四:首次鉴定半胱氨酸羧乙基化诱发HLA限制性自身免疫[4]
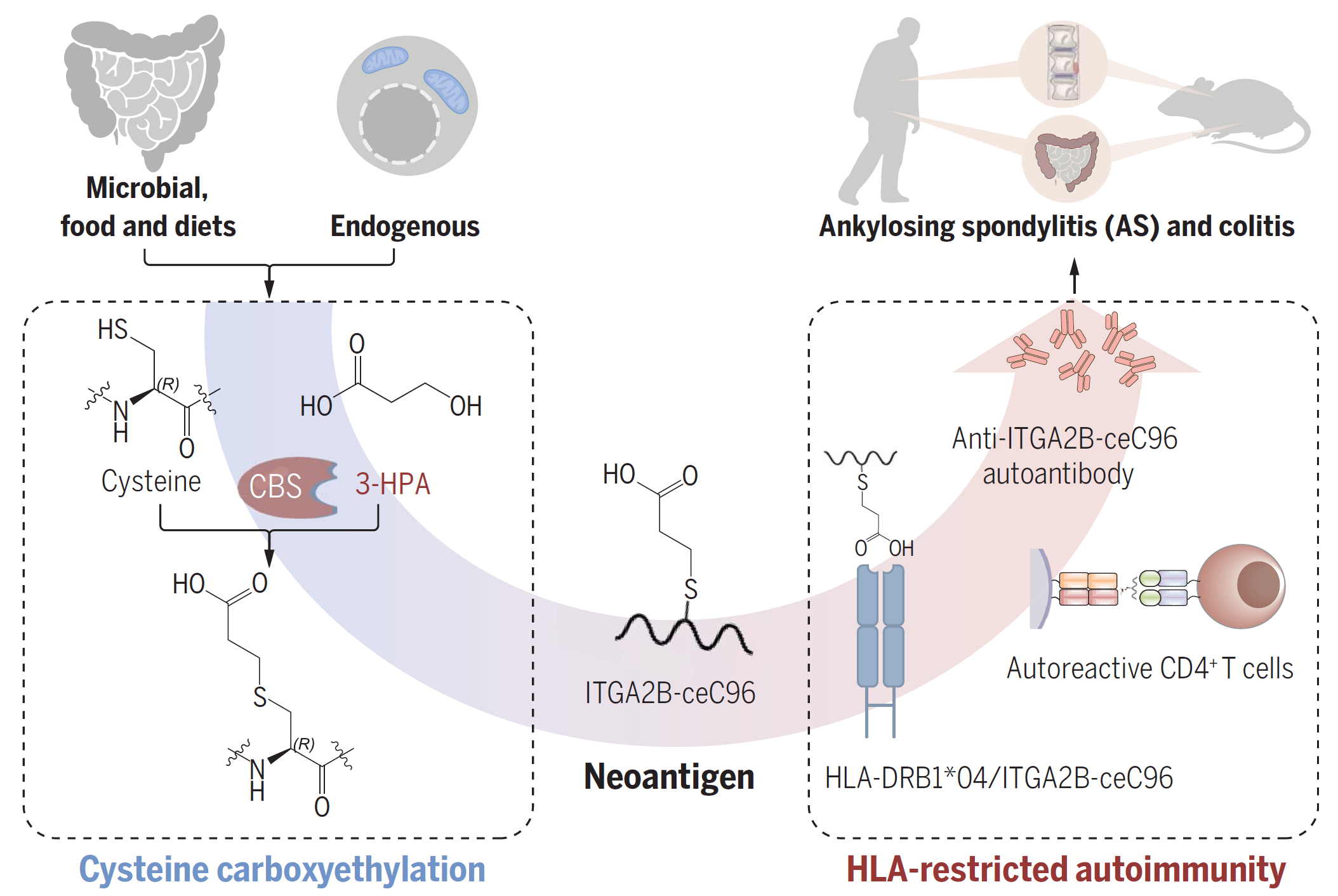
图4:半胱氨酸羧乙基化修饰生成新生抗原诱导HLA限制性自身免疫反应
2022年10月,广东省自身免疫性疾病精准医学工程研究中心戴勇团队在Molecular & Cellular Proteomics(IF=6.1)在线发表了“Global Phosphoproteomics Unveils KinaseRegulated Networks in Systemic Lupus Erythematosus”文章。系统性红斑狼疮(SLE)是一种自身免疫性疾病,该研究通过将高通量磷酸化蛋白质组学与靶向蛋白组学PRM技术相结合,建立了来自大量SLE患者的外周血单个核细胞的磷酸化蛋白质组谱,通过表达模式聚类分析发现在SLE活动期组中几个特异性上调的磷酸化位点,并且白细胞跨内皮迁移通路被富集,结合PRM验证,揭示了SLE中存在关键的激酶和激酶调控网络。案例五:磷酸化蛋白质组学揭示系统性红斑狼疮激酶调控网络[5]
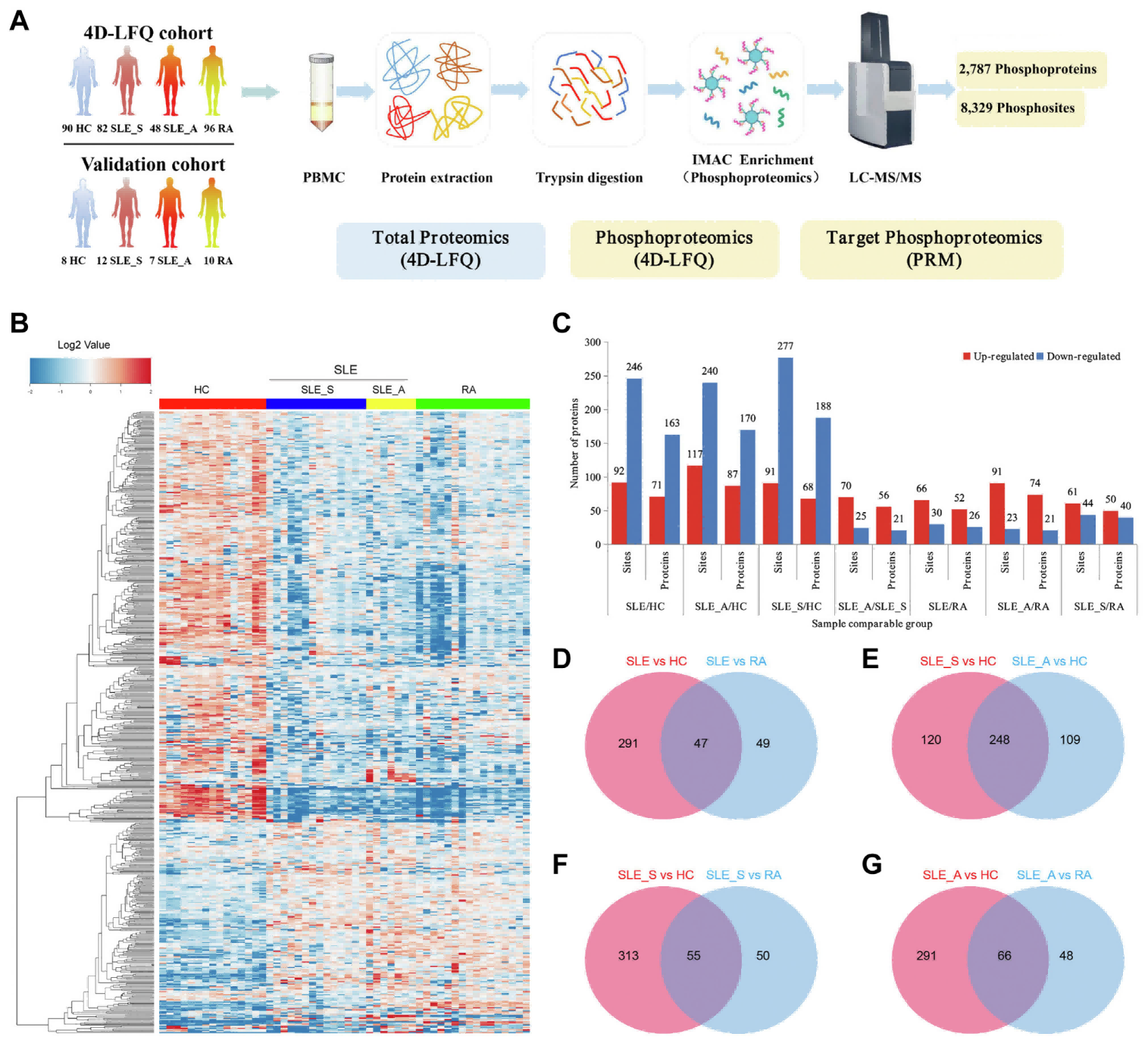
图5:系统性红斑狼疮磷酸化修饰蛋白质组学研究概述
翻译后修饰蛋白组学在风湿免疫疾病研究中扮演着至关重要的角色。通过鉴定和分析蛋白质的翻译后修饰,能够帮助科学家们揭示自身免疫反应导致的新生抗原,发现潜在的生物标志物,并进一步探索蛋白修饰之间错综复杂的相互作用网络。为早期诊断、个性化治疗以及新药开发提供了关键信息。 青莲百奥修饰蛋白组学产品线升级,不仅精心打磨了经典修饰产品线(如磷酸化、糖基化、泛素化等),同时开拓了一系列新型修饰产品线(如乳酸化、酰化修饰、氧化还原等)。现凭借先进的高分辨率、高灵敏度质谱技术,积累了丰富的修饰组学研究经验,提供深入的生物信息学分析报告,为科研工作的深入探索和成果的有效转化提供强有力的支持。 参考文献: [1] Lin Liman,Huang Zhiwen,Li Wenjuan et al. Mid1 promotes synovitis in rheumatoid arthritis via ubiquitin-dependent post-translational modification.[J] .Pharmacol Res, 2024, 205: 107224. [2] Wang Yan-Hang,Gao Peng,Wang Yu-Qi et al. Small-molecule targeting PKM2 provides a molecular basis of lactylation-dependent fibroblast-like synoviocytes proliferation inhibition against rheumatoid arthritis.[J] .Eur J Pharmacol, 2024, 972: 176551. [3] Xu Zhiqiang,Liu Yi,He Siyu et al. Integrative Proteomics and N-Glycoproteomics Analyses of Rheumatoid Arthritis Synovium Reveal Immune-Associated Glycopeptides.[J] .Mol Cell Proteomics, 2023, 22: 100540. [4] Yue, Zhai,Liang, Chen,Qian, Zhao et al. Cysteine carboxyethylation generates neoantigens to induce HLA-restricted autoimmunity.[J] .Science, 2023, 379: 0. [5] Shuhui, Meng,Teng, Li,Tingting, Wang et al. Global Phosphoproteomics Unveils Kinase-Regulated Networks in Systemic Lupus Erythematosus.[J] .Mol Cell Proteomics, 2022, 21: 0.结论
青莲百奥修饰组学解决方案
