瑞士苏黎世联邦理工学院的Paola Picotti团队,凭借其在限制性酶解-质谱分析(LiP-MS)技术的领先地位,现将视野扩展至热蛋白质组学(TPP)领域。这一跨领域的技术融合,能够从结构和热稳定性双重视角深入解析渗透剂类药物的作用机制,为药物研发带来新洞见。
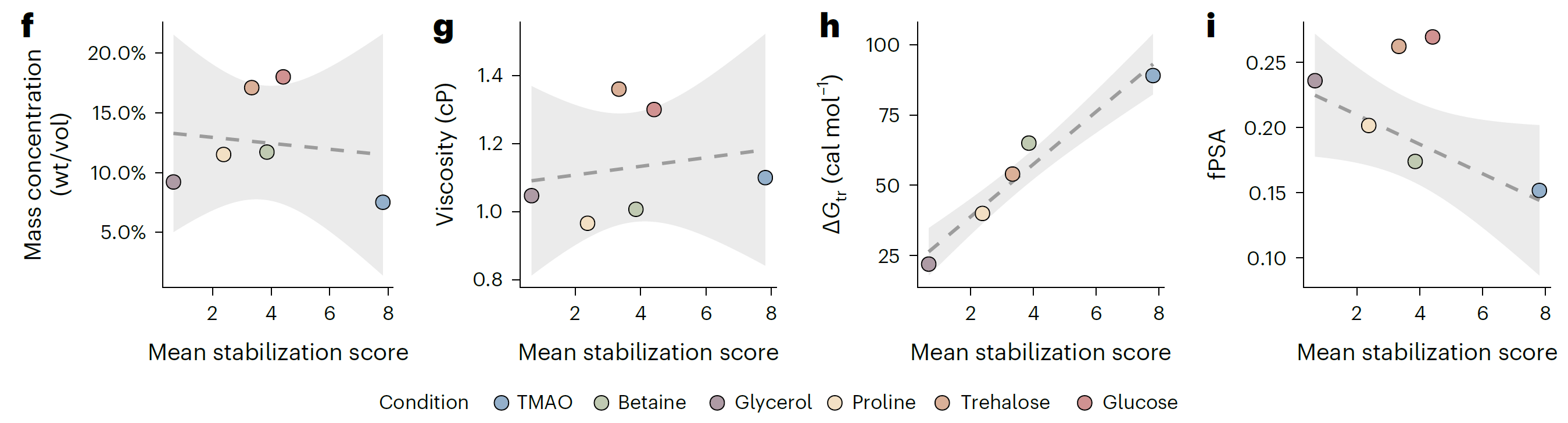
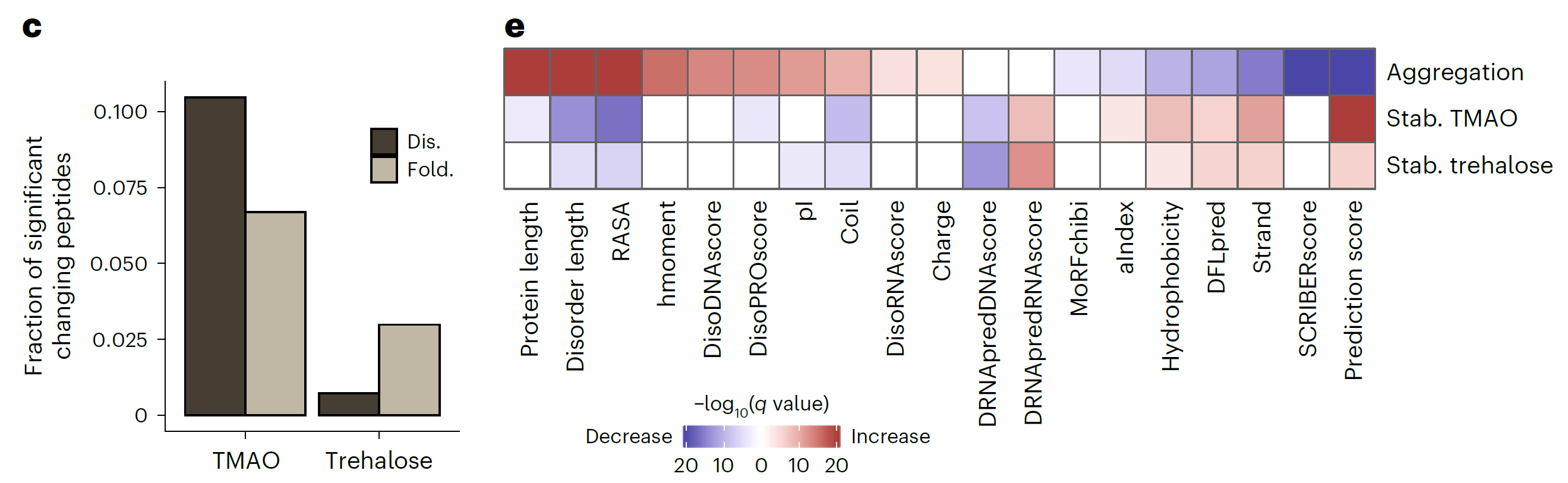
iP-MS和TPP是药物靶点研究领域的核心技术,它们通过监测小分子(如药物分子)与蛋白质结合后引起的结构或热稳定性变化来鉴定小分子的靶蛋白。传统上,这两种技术是独立应用的,各自揭示了小分子作用的不同侧面。LiP-MS精细探测小分子引起的蛋白质局部结构变化,揭示药物分子的潜在结合位点和构象效应。TPP则评估这些变化对蛋白质整体热稳定性的影响,反映其对功能的作用。结合这两种技术,研究者能全面理解药物影响靶点稳定性的作用机制,为药物设计和靶点验证提供深入见解,加速新药研发。 2024年8月,瑞士苏黎世联邦理工学院Paola Picotti团队在期刊Nat Chem Biol(IF=12.9)上发表了题为“In situ analysis of osmolyte mechanisms of proteome thermal stabilization”的研究论文,该研究创新性地结合TPP和LiP-MS深入剖析渗透剂在细胞内如何调控蛋白质组的热稳定性。研究不仅揭示了渗透剂对蛋白质结构和稳定性的深远影响,还阐明了它们在多样化温度环境下对蛋白质保护及聚集行为的精细调控机制,为生物技术领域和药物开发中有效利用这些天然分子开辟了新思路和策略。 渗透机制是细胞适应环境变化的关键策略之一。渗透剂如甜菜碱和三甲胺-N-氧化物(TMAO)在细胞中积累,帮助细胞适应环境变化,影响蛋白质聚集,对心血管疾病研究至关重要。体外研究表明渗透物能够热稳定蛋白,但机制仍有争议,并在细胞环境中缺乏系统的研究。LiP-MS可以检测蛋白质的聚集变化,但是LiP-MS数据本身无法明确区分聚集与其它导致蛋白酶敏感性降低的结构变化,因此引入了TPP来监测蛋白质的热诱导聚集来评估其热稳定性,从而补充LiP-MS数据,为研究提供了更全面的视角。 LiP–MS thermal profiling(LiP-MS+TPP)是将蛋白酶K(PK)添加到暴露于温度梯度的天然裂解物等分液中,PK可切割蛋白的柔性和可接近区域,随着温度的升高,蛋白聚集,越来越少的区域被PK切割,通过检测不同温度梯度下产生的不同肽段丰度,以产生每种蛋白的热剖面。 实验流程 一、渗透剂对大肠杆菌蛋白质组热稳定性的影响 作者首先来评估不同渗透剂对大肠杆菌蛋白质组热稳定性的影响。通过将大肠杆菌裂解液暴露于六种不同的渗透剂(包括TMAO、甜菜碱、甘油、脯氨酸、海藻糖和葡萄糖),观察到这些化学物质如何影响蛋白质的热稳定性。研究结果显示,所有测试的渗透剂都能在一定程度上提高蛋白质的热稳定性。其中,TMAO显示出最强的稳定效果,能够稳定大部分检测到的蛋白质(67.2%),而甘油的稳定效果相对较弱。这些发现为理解渗透剂如何在细胞内环境中保护蛋白质免受热变性提供了新的见解,并可能对开发新的蛋白质稳定化策略具有重要意义。 渗透剂对大肠杆菌蛋白质组热稳定性的影响 二、渗透剂诱导的蛋白质聚集温度上移来抵抗蛋白沉降 实验观察到所有测试渗透剂均促使蛋白质聚集的温度阈值上移,这一现象揭示了渗透剂通过增强蛋白质结构的稳定性,有效延迟了蛋白质的聚集过程。 渗透剂诱导的蛋白质聚集温度上移来抵抗蛋白沉降 三、渗透剂通过优先排斥机制稳定蛋白 该研究利用HEK293T细胞模型,采用LiP–MS thermal profiling深入分析多种渗透剂对人类蛋白质组热稳定性的影响。结果发现渗透剂主要通过优先排斥机制来稳定蛋白质,即渗透剂与蛋白质相互排斥,使得蛋白质更倾向于保持其紧密折叠的状态,从而在细胞内环境中增强了蛋白质的热稳定性。此外,还发现特定蛋白质可能通过与渗透剂的直接结合来增强热稳定性。 渗透剂通过优先排斥机制稳定蛋白 四、TMAO渗透剂的特异性效应 尽管多数渗透剂对蛋白质的稳定作用具有普遍性,但特定渗透剂如TMAO对有结构的蛋白质和无序蛋白质的影响存在差异,能够稳定球状蛋白质同时促进大型无序蛋白质的聚集。 TMAO渗透剂的特异性效应 LiP–MS thermal profiling技术不仅深化了我们对细胞借助渗透剂应对环境压力机制的认识,还为探究蛋白质在多变环境条件下的稳定性与功能活性提供了强有力的分析平台。此技术在药物研发领域尤其重要,它有助于筛选和优化潜在药物分子,评估它们对蛋白质稳定性及聚集行为的作用,进而提升药物的有效性并降低潜在的副作用风险。 药物靶点在医药研发中至关重要,它们是药物作用的生物分子,涵盖蛋白质、酶、受体等,对调节生物体的生理和病理过程起着决定性作用。药物靶点的发现和验证是新药研发的首要步骤,直接关系到研发的成败。青莲百奥生物科技有限公司专注于临床需求,以源头创新为动力,利用其专业平台,结合限制性酶解-质谱分析技术(LiP-MS)和热蛋白质组学(TPP),打造了高效的药物靶点发现平台。这一平台不仅加速了药物筛选过程,还提高了药物的疗效和安全性,为个性化医疗提供了强有力的技术支持。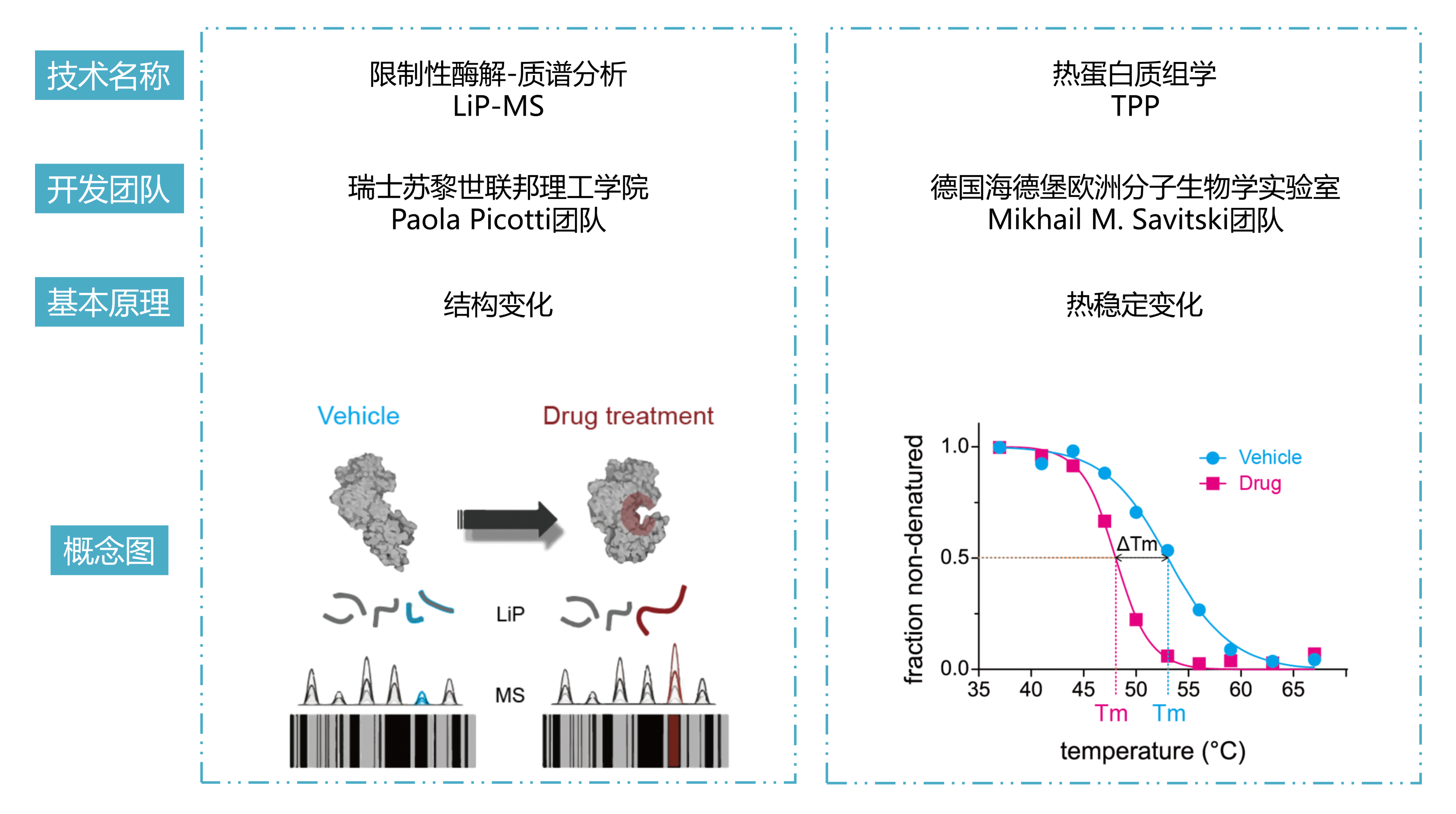
蛋白质组热稳定渗透机制的原位分析
渗透机制
技术流程
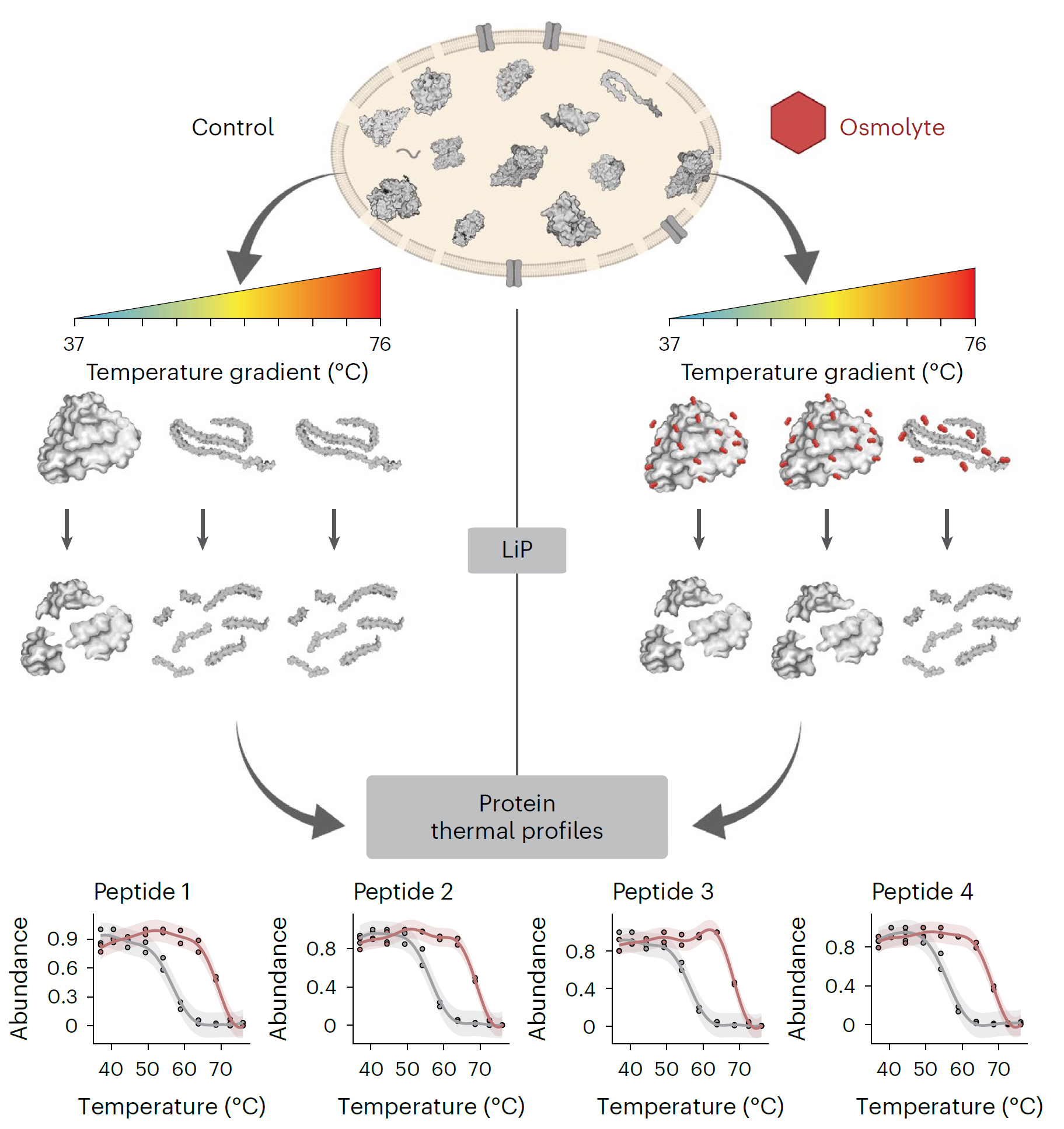
实验结果
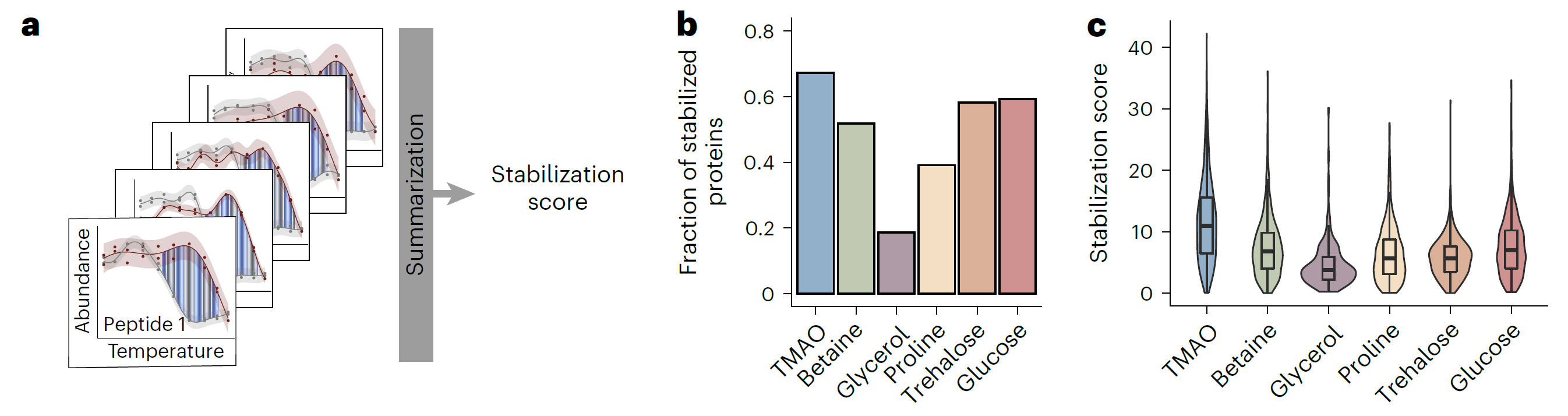
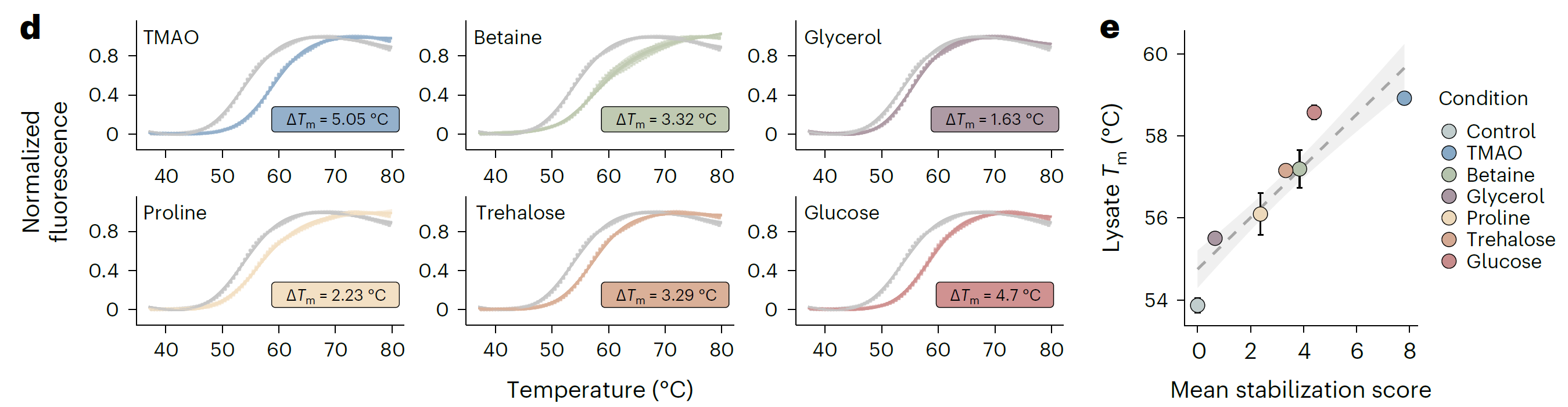
实验结论
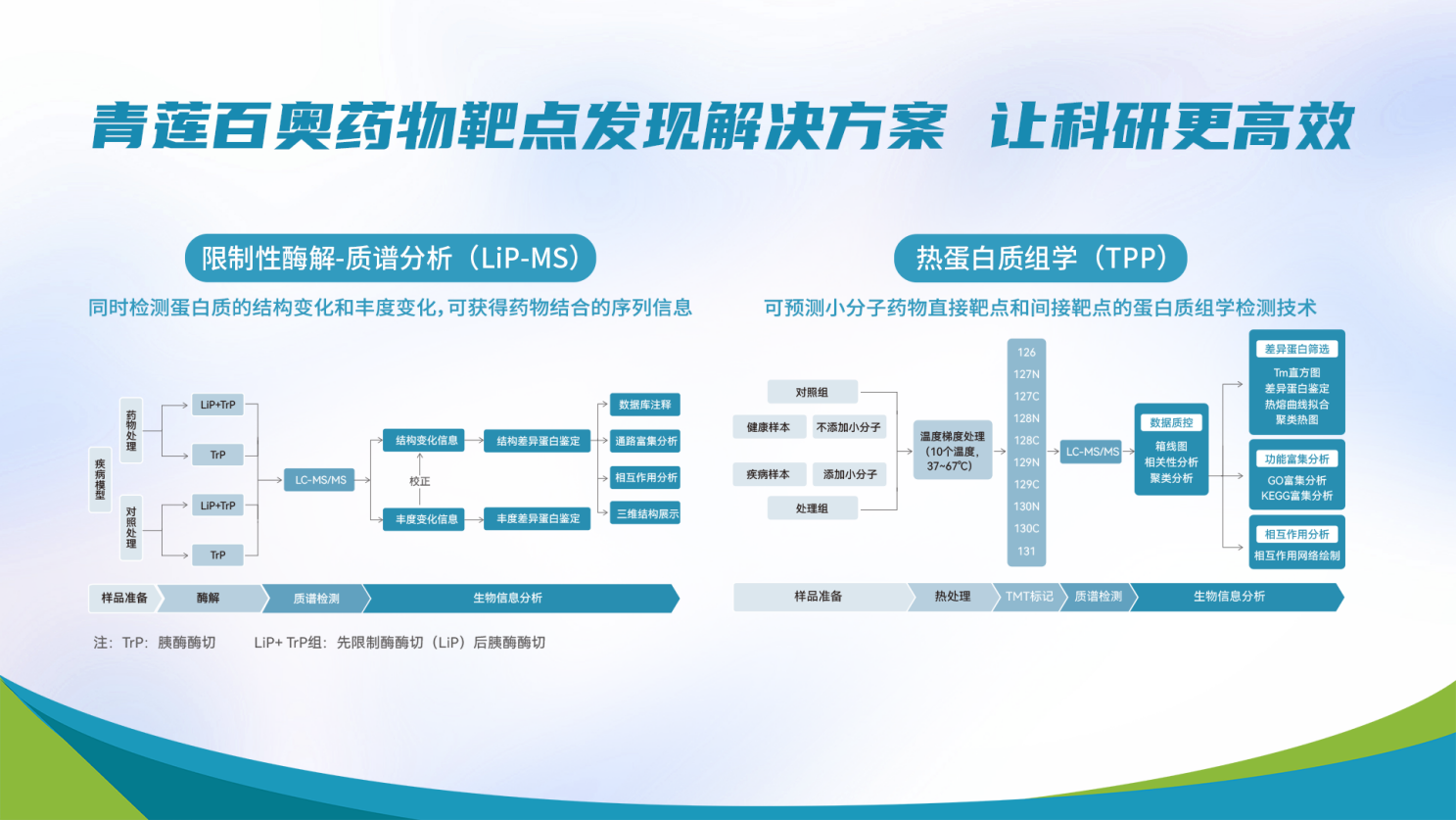
青莲百奥药物靶点发现解决方案
参考文献: [1] Pepelnjak M, Velten B, Näpflin N, et al. In situ analysis of osmolyte mechanisms of proteome thermal stabilization [J]. Nature Chemical Biology, 2024, 20(8): 1053-1065.